Modèle de Bohr et quantification de l’énergie
Pourquoi le modèle de Bohr ?
1. Introduction
Nous avons vu dans le chapitre précédent que les échanges ou transferts d’énergie se font au sein de l’atome par les électrons et que cette énergie qui circule est quantifiée. C’est comme si on se plaçait face à un robinet un peu particulier (un robinet quantique ?) avec lequel on pourrait certes s’approvisionner en eau, mais pas de façon continue comme habituellement ; habituellement, on place une bouteille vide sous le robinet et la bouteille se remplit peu à peu. À chaque instant, il y a une petite quantité d’eau en plus dans la bouteille. On peut d’ailleurs représenter le remplissage de la bouteille en fonction du temps par une fonction mathématique continue (probablement une droite si le débit n’est pas modifié au cours du remplissage). Ici, il n’en est rien. Des fois, j’obtiens 3,5 litres d’un seul coup ; d’autres fois 2,3 litres d’un seul coup. Mais jamais un écoulement progressif.
En l’occurrence, le modèle de Bohr permet de préciser certains aspects du « fonctionnement » de l’atome et surtout des électrons, d’introduire certaines notions comme le spin et surtout d’expliquer le pourquoi des niveaux d’énergie quantifiés....
Modèle de Bohr
1. Précisions concernant les orbites
Chaque orbite autour du noyau central est donc associée à un niveau d’énergie comme présenté dans le schéma suivant :
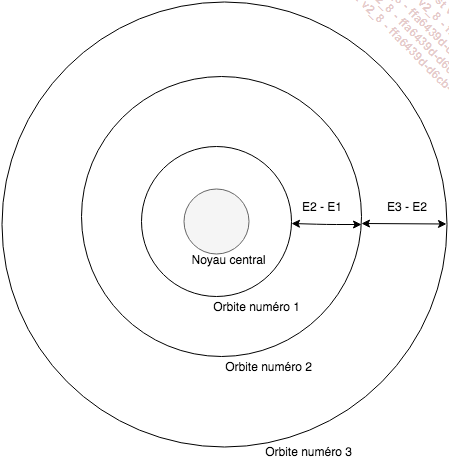
Illustration 2 : Modèle schématique de Bohr à trois orbites
À l’orbite numéro 3 est donc associé le niveau d’énergie E3. Pour qu’un électron passe de l’orbite numéro 3 à l’orbite numéro 2, il faut lui transmettre une énergie égale à E3 - E2. Un tel passage d’une orbite à l’autre s’appelle - comme évoqué dans la section précédente - l’absorption. D’où provient l’énergie nécessaire à ce passage de type absorption d’une orbite à l’autre ? Du rayonnement électromagnétique auquel l’atome est soumis, et plus précisément à l’absorption d’un photon.
L’électron peut au contraire s’éloigner du noyau. Dans ce cas, il y a émission d’un photon. Ce phénomène s’appelle l’émission spontanée ou émission induite quand elle se produit grâce à un dispositif extérieur.
2. Modèle de Bohr et nombres quantiques
Quatre nombres quantiques permettent de modéliser les électrons dans...
 Editions ENI Livres | Vidéos | e-Formations
Editions ENI Livres | Vidéos | e-Formations
